À retenir :
- Une molécule est un grain de matière invisible à l’œil nu. Par exemple, une molécule d’eau est la plus petite quantité d’eau que l’on peut obtenir.
- La matière (à l’état solide, liquide ou gaz) est constituée de molécules.
Etat solide : compact, ordonné, immobile, liées
Etat liquide : compact, désordonné, en mouvement, peu liées
Etat gazeux : dispersé, désordonné, en mouvement, non liées
Chapitre 2 : L'air, un mélange de molécules

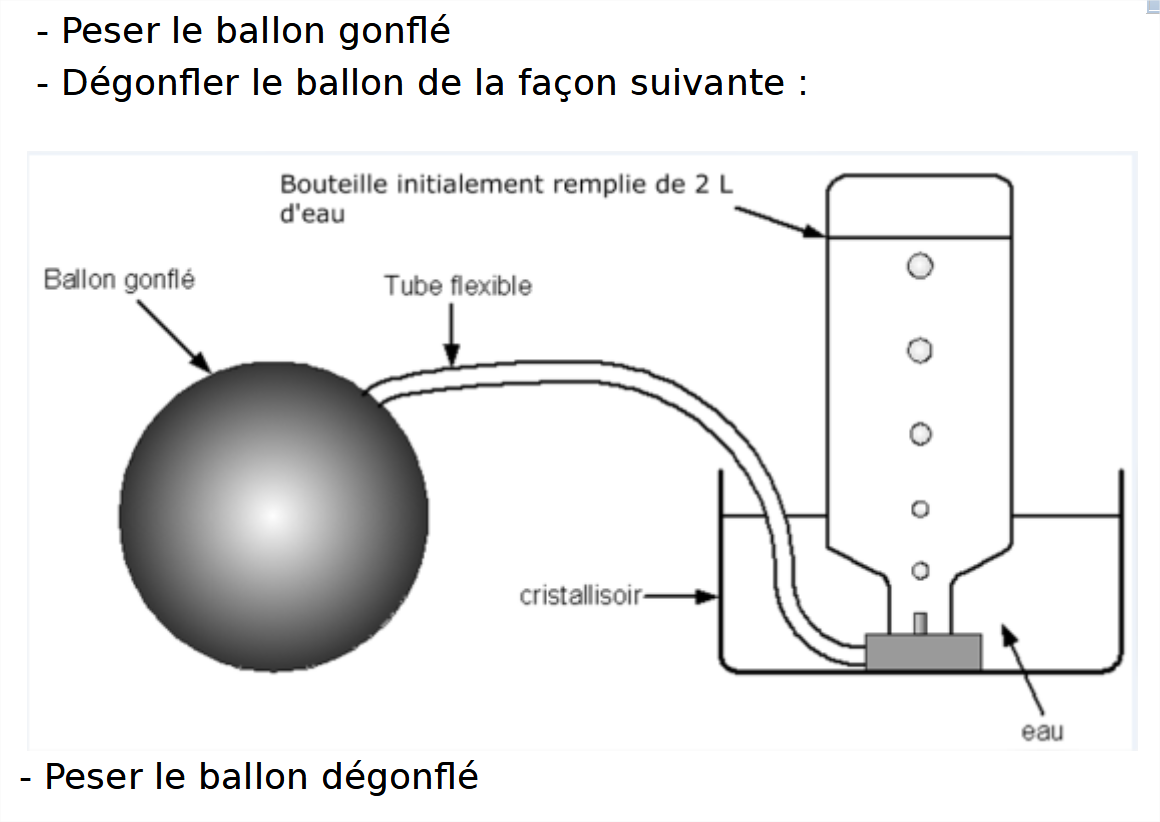
Activité : facturer l'air
Résultats :
- masse du ballon gonflé : 242,7 g
- masse du ballon dégonflé : 240,1 g
- volume de l'air dans la bouteille : 2 L
Interprétation :
Masse d'air sorti du ballon :
242,7 - 240,1 = 2,6 g
Le ballon a perdu 2,6 g d'air (qui sont partis dans la bouteille).
La masse d'un litre d'air est égale à 1,3 g.
Conclusion :
Afin de déterminer la masse d'un litre d'air, il faut peser le ballon (deux fois) puis mesurer le volume extrait.
5) Calculer 21 % de 200 L :
21/100 x 200 = 42 L
Le volume de dioxygène est égal à 42 L.
à retenir :
- L'atmosphère est une enveloppe gazeuse qui entoure la planète.
- C'est elle qui retient l'air nécessaire à la vie.
- Nous vivons dans la troposphère, l'air est composé à :
78 % de diazote
21 % de dioxygène
1 % d'autres gaz
Pour simplifier: l’air est un mélange de gaz composé de 4/5 de diazote et 1/5 de dioxygène.
La pression se mesure* en hPa (hectoPascal) et elle diminue en altitude.
*à l’aide d’un manomètre
Activité : MODH
On ne trouve pas le symbole M ni le symbole D.
Ce texte ne semble pas tout à fait clair dans les termes.
Activité : composition de l'air page 70
D'après l'expérience de Lavoisier, les résultats sont les suivants :
Volume d'air total : 0,8 L
Volume de dioxygène : 0,14 L
Interprétation :
0,14 x 100 = 17,5 %
0,8
Calcul de l'angle des portions dans un diagramme circulaire :
86 % de H2
13 % d'helium : He
1 % d'autres gaz